Độ âm điện là gì? Độ âm điện đặc trưng cho khả năng nào trong liên kết hóa học của nguyên tử? Vì sao dựa vào bảng giá trị độ âm điện người ta có thể so sánh được tính kim loại và phi kim? Tất cả sẽ được giải đáp trong bài viết dưới đây của chuthapdoquangninh.org.vn, cùng tìm hiểu nhé!
Tìm hiểu về độ âm điện
Khái niệm độ âm điện là gì?
Độ âm điện của nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử đó và tạo thành liên kết hóa học.
Độ âm điện là đại lượng đặc trưng khả năng hút electron của một nguyên tử
Như vậy, độ âm điện của nguyên tử càng lớn thì tính kim loại của nguyên tử đó càng mạnh. Ngược lại, độ âm điện của nguyên tử càng nhỏ thì tính phi kim của nguyên tử đó càng mạnh.
Nguyên nhân gây ra độ âm điện là gì?
Ở mức độ cơ bản nhất thì độ âm điện được xác định bởi các yếu tố như: điện tích hạt nhân, số lượng, vị trí của electron khác trong vỏ nguyên tử. Nguyên tử càng có nhiều electron thì số electron sẽ có hoá trị càng xa hạt nhân.
Thang đo độ âm điện như thế nào?
Thang đo độ âm điện của các nguyên tử có nhiều cách để đo, nhưng phổ biến nhất là thang đo âm điện của Pauling thiết lập năm 1932. Thang đo này có quy ước sử dụng độ âm điện của Flo (bởi Flo có tính phi kim mạnh nhất) làm chuẩn để xác định các nguyên tố còn lại.
Phương trình độ âm điện
Dựa trên một số thí nghiệm và tính toán cẩn thận, Pauling đã đưa ra một phương trình phức tạp có tính tương đối với 2 nguyên tử trong phân tử như sau:
EN(a) – EN (b) = 0,102 (Δ1 / 2)
Đơn vị và ký hiệu độ âm điện là gì?
Độ âm điện không được đo bằng đơn vị năng lượng mà đo dựa trên một thang đo tương đối nên không có đơn vị.
Ký hiệu độ âm điện là là χ (chữ cái Hy Lạp).
Sự biến đổi giá trị độ âm điện
Độ âm điện của các nguyên tố trong bảng tuần hoàn là biến đổi có quy luật được xác định. Quy luật đó là:
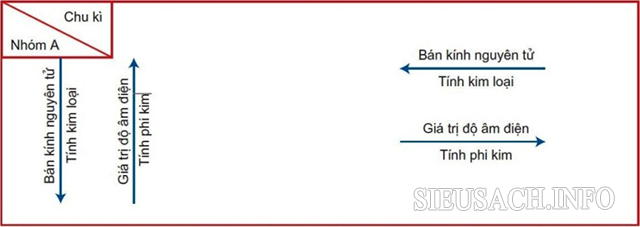
Sự biến đổi các giá trị độ âm điện của các nguyên tố
- Trong cùng của một chu kỳ: nếu chiều điện tích hạt nhân tăng dần theo chiều từ trái sang phải thì độ âm điện của nguyên tử các nguyên tố đó thường tăng dần.
- Trong cùng một nhóm B: nếu tính theo chiều từ trên xuống dưới, điện tích hạt nhân tăng dần thì độ âm điện thường sẽ theo hướng giảm dần.
Cách tính độ âm điện và hiệu độ âm điện, liên kết hóa học
Hiệu độ âm điện chính là hiệu số giá trị của độ âm điện trong nguyên tử của 2 nguyên tố hóa học. Dựa vào hiệu độ âm điện, có thể đưa ra được các kiểu liên kết hóa học của một phân tử.
Cách tính hiệu độ âm điện của 2 nguyên tử rất đơn giản. Bạn chỉ cần làm phép tính hiệu lấy giá trị lớn hơn của nguyên tử nguyên tố này đem trừ đi giá trị nhỏ hơn của nguyên tử nguyên tố kia là xong.

Hiệu độ âm điện và các liên kết hóa học
Liên kết cộng hóa trị không cực của nguyên tử
Nếu hiệu độ âm điện của các nguyên tử tham gia vào liên kết hóa học có hiệu nằm trong khoảng: 0 – < 0.4 thì liên kết đó gọi là liên kết cộng hóa trị không phân cực. Độ phân cực của liên kết < 0.4 là một số quá nhỏ nên không xác định được trong thực tế.
Liên kết cộng hóa trị có cực
Liên kết cộng hóa trị có cực được tạo nên từ các nguyên tử có hiệu độ âm điện nằm trong khoảng giá trị từ 0.4 – < 1.7. Nếu giá trị này càng lớn thì liên kết có độ phân cực càng cao.
Liên kết ion
Nếu hiệu độ âm điện có giá trị ≥ 1.7 thì liên kết hóa học đó gọi là liên kết ion. Khi đó nguyên tử có độ âm điện lớn hơn sẽ có khả năng hút được electron đủ mạnh.
Nhờ đó, nguyên tử có thể có khả năng hút electron đủ mạnh để nhận được hoàn toàn electron của nguyên tử còn lại, và tạo thành ion âm. Còn những nguyên tử bị mất electron trong quá trình phản ứng hóa học sẽ trở thành ion dương.
Bảng độ âm điện của các nguyên tố hóa học
Bảng giá trị độ âm điện của Pauling lấy nguyên tử Flo là chất hóa học có tính phi kim mạnh để xác định độ âm điện tương đối của các nguyên tử nguyên tố khác. Dưới đây là bảng độ âm điện của nguyên tố hóa học:
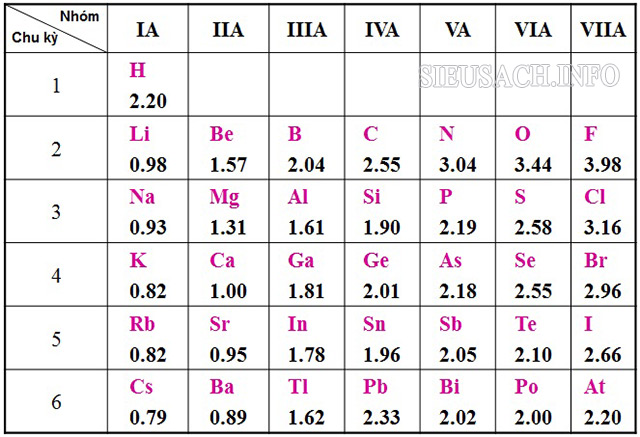
Bảng độ âm điện các nguyên tố hoá học
Độ âm điện của kim loại kiềm
- Độ AĐ của Li: 0.98
- Độ AĐ của Na: 0.93
- Độ AĐ của K: 0.82
- Độ AĐ của Rb: 0.82
- Độ AĐ của Cs: 0.79
Độ âm điện của halogen
- Độ AĐ của F: 3.98
- Độ AĐ của I: 2.66
- Độ AĐ của Cl: 3.16
- Độ AĐ của Br: 2.96
- Độ AĐ của At: 2.20
Độ âm điện của kim loại kiềm thổ
- Độ AĐ của Be: 1.57
- Độ AĐ của Mg: 1.31
- Độ AĐ của Sr: 0.95
- Độ AĐ của Ba: 0.89
- Độ AĐ của Ca: 1.00
Độ âm điện của khí hiếm
- Độ AĐ của khí hiếm Kr: 3.00
- Độ AĐ của khí hiếm Xe: 2.60
- Độ AĐ của khí hiếm He: không có dữ liệu
- Độ AĐ của khí hiếm Ne: không có dữ liệu
- Độ AĐ của khí hiếm Ar: không có dữ liệu
- Độ AĐ của khí hiếm Rn: không có dữ liệu
Các yếu tố ảnh hưởng đến độ âm điện
Điện tích hạt nhân
Điện tích hạt nhân lớn thì độ âm điện tỉ lệ thuận cũng có giá trị lớn. Nguyên nhân là do sự gia tăng điện tích hạt nhân gây ra các lực hút của electron với lực lớn hơn.
Kích thước của nguyên tử
Kích thước nguyên tử nhỏ thì giá trị độ âm điện sẽ lớn và ngược lại kích thước nguyên tử lớn hơn thì giá trị độ âm điện sẽ nhỏ. Điều này xảy ra do các hạt electron ở xa hạt nhân sẽ chịu ít lực hút hơn từ hạt nhân.
Tác dụng của nhóm thế
Độ âm điện của nguyên tử trong nhóm thế phụ thuộc vào bản chất của nhóm thế đó. Ví dụ: nguyên tử Cacbon trong phân tử CF3I thu được điện tích dương lớn hơn trong CH3I. Do đó, nguyên tử C trong CF3I sẽ có độ âm điện lớn hơn CH3I. Sự khác biệt về độ âm điện của một nguyên tử trong nhóm thế sẽ quyết định đến sự liên kết hóa học khác nhau của nguyên tử đó.
Trên đây là những thông tin về độ âm điện là gì, kí hiệu, cách tính, bảng độ âm điện và một số kiến thức liên quan. Hi vọng, với những chia sẻ trong bài viết này sẽ giúp bạn củng cố thêm về kiến thức hóa học của mình.




